Saludos amigos de steemit y de la prestigiosa comunidad científica de
#stem-espanol. Ya en una ocasión, tuve la oportunidad de hablarles de una de las herramientas utilizadas para la protección de metales contra la corrosión:
Ánodos de sacrificio en la protección de superficies metálicas
La protección de los metales siempre ha sido una premisa a nivel industrial, muchos de los componentes de equipos, maquinarias y piezas utilizadas en empresas, están sometidas a condiciones ambientales corrosivas. La humedad, altas temperaturas, salinidad y la presencia de sustancias que actúan como oxidantes, son algunas de las principales causas de la degeneración de los metales producto de la corrosión.
La corrosión es el principal enemigo de los metales
 Fuente
Fuente
Es por ello que cada vez es más necesario que los metales con los que se fabrican estos componentes sean blindados a estos factores, con la finalidad de garantizar su protección contra estos procesos degenerativos y alargar su vida útil. Por tal razón se emplea un proceso electroquímico conocido como electrodeposición o galvanizado electroquímico, el cual fue descubierto por el italiano Luigi Galvani al percatarse que cada metal posee una carga eléctrica distinta, y que dichas diferencias de carga podían aprovecharse para producir cambios físicos en ellos.
Luigi Galvani, nació en Bolonia Italia el 9 de septiembre de 1737, es considerado uno de los padres de la electroquímica.
.jpeg) Fuente
Fuente
En esta publicación les describiré brevemente los fundamentos de dicho proceso y los beneficios de su aplicación para el recubrimiento de superficies metálicas.
Electrodeposición
Se define como un proceso electroquímico mediante el cual se logra el recubrimiento de un metal con una capa o película de otro, para que esto pueda llevarse a cabo es necesario que ocurra un flujo electrónico desde un ánodo que en este caso estaría representado por el metal con el que se realiza el recubrimiento, a un cátodo que vendría a ser la pieza o superficie metálica a recubrir, el empleo de la electricidad producirá que los cationes metálicos del ánodo pasen a una solución acuosa donde posteriormente se reducirán y terminaran precipitando sobre la superficie del cátodo formando una película, el metal de recubrimiento siempre presentara una carga eléctrica mayor al metal donde ocurre la deposición catiónica.
El sistema acuoso para la realización de este proceso debe poseer la conductividad suficiente para facilitar el flujo electrónico, además de poseer los iones metálicos del material con el cual se desea realizar el recubrimiento, por ello que es habitual el uso de sus sales en un medio acido.
Recubrimiento de un metal por electrodeposición del cobre
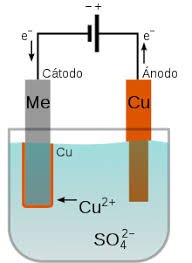 Fuente
Fuente
En la electrodeposición del cobre como se muestra en la imagen anterior, se lleva acabó en una solución acuosa que contiene sulfato de cobre, el ánodo al ser sometido a un flujo eléctrico se oxida liberando más cationes de cobre que al saturar la solución terminan precipitando sobre el cátodo, dónde nuevamente se reducirán producto de las cargas negativas suministradas de la fuente de energía, volviendo a su estado metálico en forma de película sobre la superficie catódica.
Reacciones involucradas en la electrodeposición del cobre
 Imagen de elaboración propia
Imagen de elaboración propia
La electrodeposición parte de una reacción Redox, en donde por medio de la aplicación de energía eléctrica se forzara la oxidación del metal de recubrimiento para que aporte sus cationes a la solución acuosa, al encontrarse sumergida en esta la pieza metálica a recubrir y a su vez sometida a una carga eléctrica negativa, todos los cationes liberados por el metal de recubrimiento serán atraídos hacia esta y por ende se depositaran de manera uniforme a lo largo de su superficie.
En este proceso casi siempre el material a recubrir presentara un costo de inferior al que se utiliza para realizar el recubrimiento, siendo a su vez es más proclive a la oxidación o corrosión, esto se hace con la finalidad de mejorar sus propiedades fisicoquímicas, ejemplo de ello lo son los recubrimientos de piezas de hierro con zinc o la aplicación de baños de oro o plata en la joyería.
Metales usados en la electrodeposición o galvanizado electroquímico
Los principales metales utilizados para el recubrimiento contra la corrosión de piezas de hierro y acero son: el aluminio, el cromo, el zinc y el cadmio. Ya que estos además de protegerlo de los factores externos actúan como ánodos de sacrificio.
La plata, níquel, estaño, cobre y oro son muy utilizados cuando además de protección contra la corrosión, se requiere mejorar las propiedades de conducción eléctrica y decorativa de los metales a recubrir.
Beneficios que ofrece la electrodeposición en piezas o superficies metálicas
A continuación se presentan los principales beneficios del empleo de esta herramienta electroquímica en la preservación de piezas y superficies metálicas.
- Protege y mejora la resistencia de los metales recubiertos contra la corrosión, ya estos estarán aislados de las condiciones externas del entorno por la capa o película de formada a lo largo de su superficie.
- Favorece la conductividad eléctrica en superficies metálicas, dependiendo de las fuerzas electromotrices de los metales usados para el recubrimiento electroquímico.
- Mejora propiedades fisicoquímicas del metal protegido, confiriéndole una mayor resistencia mecánica al desgaste, a su vez aporta rigidez y dureza a las piezas sometidas a este proceso.
Estos recubrimientos electroquímicos también pueden mejorar la resistencia y conductividad térmica de los metales, dependiendo de la capacidad calorífica que estos posean.
Sus aplicaciones en la industria de la joyería mejoran la estética de muchas piezas.
El crecimiento industrial solo es posible en función del desarrollo de las tecnologías que permitan sostenerlo, por todas estas razones, la electrodeposición es hoy en día ampliamente utilizada para la protección de metales, lo que ha permitido mantener el dinamismo de muchos procesos industriales, metales más resistentes generan procesos más eficientes.
En el siguiente vídeo complementario, se muestra de forma experimental el recubrimiento de una moneda con estaño, mediante el proceso de electrodeposición.

.jpeg)



chulo te gusta la quimica?
¡Así es! me encanta.
La electrodeposición es una técnica que puede ser utilizada en la limpieza de agua contaminada por metales, siempre y cuando se presente un electrodo de sacrificio. Gracias a la electroquimica se puede hacer cosas maravillosas y darle el enfoque que queramos ya sea, en tu caso proteger un metal o en el caso de los que laboran en el centro de investigación donde soy estudiante limpieza de aguas contaminadas.
Gracias por tu post fue muy educativo para mi y espero que sea así para las personas que se tomen la molestia de leerlo.
Tienes razón amigo @rogueofoz otra de las importantes aplicaciones de la electrodeposición es en la eliminación de partículas es suspensión en el agua. Ya que estas son atraídas por las diferencias de cargas eléctricas.
Me alegra mucho que este post te haya sido útil, gracias por tomarte tu tiempo de leer y comentar, estoy a la orden para cualquier otra inquietud.
¡Saludos!
Que buen articulo, el salitre es lo peor que hay para el metal :(
La electrólisis siempre es mejor vista por los estudiantes de química y la electrodeposición por los ingenieros químicos y la industria de procesos de galvanizado, toda una mezcla de recubrimientos! Buen trabajo mi estimado @joseleogon
Me encanto tu post muy informativo
Buen tema y de mucha aplicación en la industria sobre todo en el mantenimiento de sus maquinarias.
Muy bueno estimado Jose, teníamos tiempo sin verte por aquí que bueno que vuelves y con contenido excelente.
Interesante post. Gracias por compartir.