Reacciones con Permanganato de Potasio. El Camaleón Químico.
Saludos estimados amigos de steemit y comunidad de stem-espanol.

Fuente: imagen propia.
Permanganato de potasio
Este compuesto químico tiene un característico color purpura, es una sal compuesta por los iones potasio (K+) y permanganato (MnO4-), en este el manganeso está utilizando su estado de oxidación +7, el valor más alto para un elemento de transición con una estructura electrónica 3d; este estado de oxidación tan alto en el átomo central lo convierten en un fuerte agente oxidante, por lo que es muy utilizado en reacciones redox (de óxido-reducción).
El ión permanganato forma una estructura tetraédrica que, a diferencia de otros iones con la misma estructura como el perclorato (ClO4-), no produce soluciones incoloras, esto se debe a la transferencia de electrones desde orbitales p en el oxígeno a los d en el manganeso, estas transiciones electrónicas absorben una parte de la energía de la luz visible, y en el permanganato se producen bandas electrónicas en el sólido capaces de absorber energía en el rango de los 18000 cm-1, filtrandose el color verde y exhibiendo ese característico color purpura que se mantiene en las disoluciones acuosas.
Número de oxidación y reacciones Redox
Como sabemos, en las reacciones de oxidación y reducción se produce un intercambio de electrones entre las sustancias reaccionantes, lo que produce un cambio en el número o estado de oxidación de las especies reactivas. Este número de oxidación, es la carga eléctrica positiva o negativa, que es asignada a un átomo o ión. Las reacciones de oxidación y reducción (también llamadas redox) están constituidas por dos tipos de reactivos, uno denominado agente oxidante y el otro agente reductor. En la reacción, el agente oxidante gana electrones y se reduce su número de oxidación (es decir, sufre la reducción), mientras que el agente reductor pierde electrones y aumenta su número de oxidación (es la especie que se oxida). Ambos procesos ocurren simultáneamente.
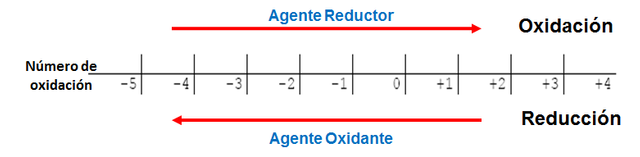
Escala de oxidación-reducción. Fuente: elaboración propia.
Reacción en disolución básica
Si a una solución alcalina, como la utilizada en el siguiente ejemplo, la cual se preparó disolviendo en 60 mL de agua 2 mL de hidróxido de sodio 6N, agregamos permanganato de potasio 0,01M, obtenemos la siguiente reacción.
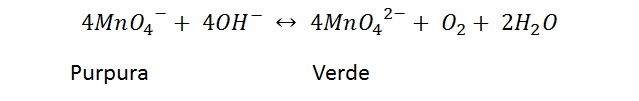
Esta reacción es un poco lenta, pero puede apreciarse mejor si elevamos la temperatura a unos 80 ºC. Vemos lo que ocurre en el siguiente video.
En el video se observa la reducción del permanganato a MnO42-, de color verde. El proceso se puede visualizar mejor si construimos las semireacciones,
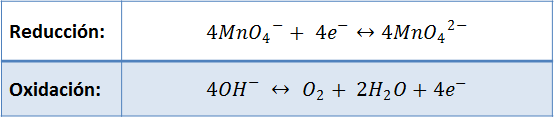
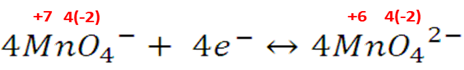
Como se menciono antes, la estructura tetraédrica del MnO42- produce colores intensos, en este caso la transición electrónica produce enlaces capaces de absorber el espectro del color purpura, produciendo el color verde.
Reacción en disolución ácida
El proceso se justifica mediante la siguiente reacción:
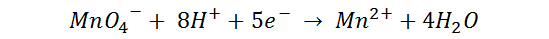
El complejo Mn2+ posee una configuración electrónica que termina en 3d5, lo que le permite la posibilidad de formar ligandos de alto spin, con energía de desdoblamiento que implica una absorción de energía en el rango del UV, manifestándose de forma incolora.
Reacción con agua oxigenada en medio ácido
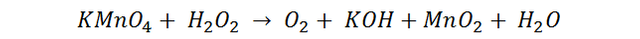
La semireacción de reducción nos muestra que el manganeso se reduce de +7 a +4.
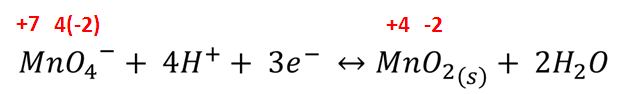
Veamos como ocurre con el siguiente video.
Reacción con sacarosa en medio básico
Como lo podemos hacer:
1.- Materiales:
 Fuente: imagen propia
Fuente: imagen propia - Un erlenmeyer
- Una plancha con agitación magnética
- 3 g de azúcar
- 3 mL de NaOH 6N
- Agua destilada.
2.- Procedimiento:
- Agregamos 200 mL de agua destilada en el erlenmeyer y en esta se vierten los 3 g de azúcar y los 3mL de NaOH. Se agita hasta disolver.
- Preparamos una disolución 0,01 M de KMnO4.
- Colocamos el erlenmeyer sobre la plancha y encendemos la función de agitación.
- Agregamos lentamente los 3 mL de la solución de KMnO4.
- y observamos el increíble resultado, como en el siguiente video.
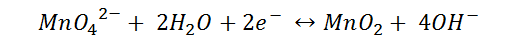
A bajas concentraciones el MnO2 no precipita, por lo que la solución en lugar de tornarse de color marrón con un sólido marrón oscuro disperso en el medio (como en la reacción con agua oxigenada), entonces, este permanece soluble y la solución adquiere ese color amarillo tostado.
Hasta aquí la presente publicación amigos, como pudieron observar, valiéndonos de conocimientos básicos de reacciones de redox podemos generar una entretenida y didáctica experiencia, disfrutando como en este caso de los llamativos colores que nos brindan las reacciones con permanganato de potasio. ¡Hasta la próxima!

Referencias
Chang, R. (2006). Química General. 7ª edición.
Skoog, West, Holler, Crouch, (2001). Química analítica. 7ª edición.
Wikipedia. Permanganato de potasio
Grupo Heurema. El problema de los colores en las disoluciones con permanganato
@emiliomoron. Excelente aporte científico amigo. Te felicito
Saludos @ulisesfl17. Muchas gracias amigo!
upvote for me please? https://steemit.com/news/@bible.com/2sysip
Buen post @emiliomoron. Se nota tu esmero en este artículo bien redactados y con vídeos de elaboración propia, además del tema que segurmante debe apasionar a los químicos como muchos otros. Éxito!
Saludos @eniolw, gracias por el comentario, me alegra que se note el esfuerzo. Bueno, esa es la idea, espero que tanto los químicos como todos los lectores disfruten el tema y los videos. Gracias por pasar a leer amigo.
Excelente @emiliomoron. Muy buena explicación acompañada de su respectivo vídeo. Saludos.
Saludos estimado @josedelacruz. Muchas gracias por el comentario y por pasar a leer, me alegra que le haya gustado el contenido.
El "Camaleón Químico" ya lo había visto antes, pero la explicación que das sobre los cambios en la coloración debido a las transiciones energéticas y variaciones estructurales fueron extraordinarias!, te felicito por compartir tus conocimientos en la comunidad.
Saludos amigo @azulear. Muchas gracias, viniendo este comentario del experto en el tema de los colores es un gran reconocimiento!. Y si, el video del experimento se puede encontrar en varios sitios, pero note que no profundizaban en la explicación del fenómeno, por eso quise compartirlo con la comunidad con una explicación un poco más amplia.
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
thank you very much for the support friends!!
Congratulations @emiliomoron! You have completed the following achievement on Steemit and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
SteemitBoard World Cup Contest - Let's go for the Quarter-Finals
Participate in the SteemitBoard World Cup Contest!
Collect World Cup badges and win free SBD
Support the Gold Sponsors of the contest: @good-karma and @lukestokes
He quedado impresionada con estas reacciones. Realmente cambia de color tal cual un camaleón. Me encantaría hacer este experimento. Gracias por este contenido tan enriquecedor. Saludos
Hola @maurelvys, me alegra que te gustara. Si, especialmente la reacción con sacarosa es tal cual. Si esta en tus posibilidades realizarlo adelante, te aseguro que te gustara aún más verlo directamente.
Aww.. esto me recuerda a mi tercer semestre. Completamente hermoso!
Si, este tema es básico en el estudio de la química, si se hicieran más experimentos así seguro muchos más se enamorarian de la materia jeje. Gracias por comentar @grisvian
Que bellos colores, me gusto eso de camaleón químico.
Saludos Breili. Me alegra que te gustara, ciertamente son muy llamativos colores y la transición entre ellos.