Demostración del Principio de Le Chatelier, equilibrio químico en una gaseosa |Área: Química de las Reacciones |
Principio de Le Chatelier

Henry Louis Le Châtelier, fue un químico Francés.
Principio de Le Chatelier:
El Principio del químico Le Chatelier, se refiere a que cuando un estado de equilibrio químico se mantiene no variara mientras las condiciones del sistema no se modifique. Cuando cambia un parámetro, como por ejemplo los tres casos existentes, la temperatura, la presión y la concentración de algunos de los reactivos o de los productos en equilibrio, la reacción tendera a cambiar bien sea a consumirse los reactivos para producir más producto o el producto se descompondrá para generar más reactivo hasta alcanzar un nuevo estado de equilibrio.
Entendamos que A + B producen C
Donde A + B son los Reactivos y C el producto
Una vez entendida la conceptualización del principio expliquémoslo con más detalles y con varios ejemplos puntuales.
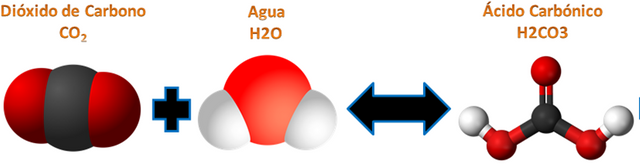
Ejemplo de las bebidas gaseosas: 2CO2 + H2O produce H2CO3 +CO2
Tanto los reactivos como los productos están en equilibrio; es decir; para producir una bebida gaseosa necesitaríamos 2 moléculas de CO2 (Dióxido de Carbono) y 1 molécula de H2O (Agua) para producir 1 molécula de H2CO3 (ácido Carbónico) y 1 molécula de CO2 gaseoso libre.
Ecuación química de las bebidas gaseosas.
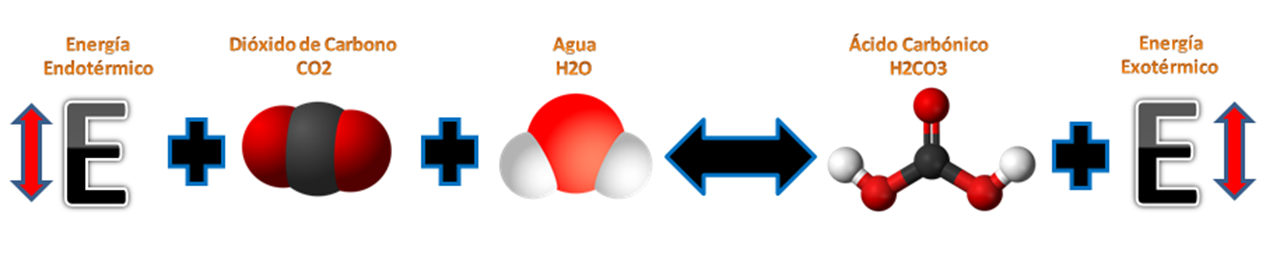
Caso N° 1: Equilibrio química por temperatura.
Para entender este caso debemos entender primero que significa la entalpia para conocer si nuestra reacción es Exotérmica (Libera energía) o endotérmica (Absorbe energía); que no es más que una magnitud que expresa la variación o diferencial de energía absorbida o liberada por un sistema termodinámico.
• Si es endotérmica, al aumentar el equilibrio químico se desplaza hacia la derecha para formar productos. En cambio, si la temperatura baja el equilibrio químico de la reacción se desplaza hacia la izquierda generando reactivos.
• Si es exotérmica, al aumentar la temperatura equilibrio químico de la reacción se desplaza hacia la izquierda generando reactivos por la descomposición de los productos, mientras que si la temperatura disminuye, el equilibrio se desplaza hacia la derecha consumiendo los reactivos en productos.
Equilibrio químico por temperatura de las bebidas gaseosas.
Caso N° 2: Equilibrio químico por Presión.
En cuanto la presión, esta se refiere a que si se aumenta la presión esta tiende a formar más productos consumiendo los reactivos y si baja la presión, los productos se consumen para formar nuevamente los reactivos.
Equilibrio químico por presión de las bebidas gaseosas.
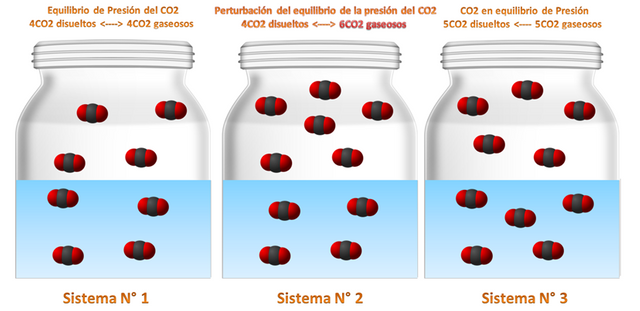
Sistema N° 1: como verán tenemos que en el sistema 1, hay 4 moléculas de CO2 disueltos y 4 moléculas de CO2 gaseosas libres lo que están equilibrio.
Sistema N° 2: por otra parte si perturbamos el sistema como se aprecia agregándole 2 moléculas de CO2 este se desequilibra porque la relación queda 6 gaseosas y 4 disueltas.
Sistema N° 3: ahora la reacción buscara equilibrarse haciendo que la reacción busque a la derecha ósea a los productos disolviendo 1 molécula de CO2 en el agua equilibrándose así una vez más.
Caso N° 3: Equilibrio químico por Concentración.
Equilibrio químico por concentración de las bebidas gaseosas.
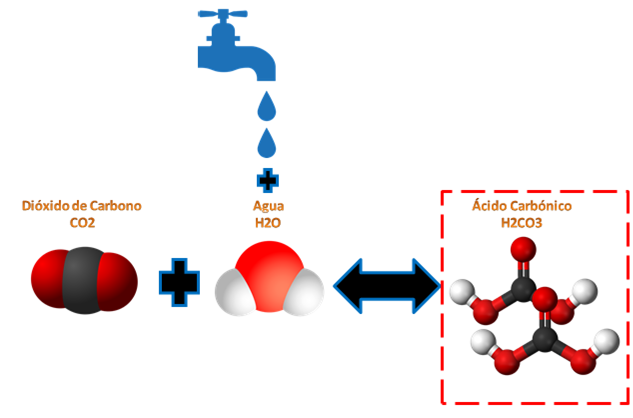
Para el caso de los equilibrios químicos por concentración, tenemos que si una reacción de 2CO2 + H2O produce H2CO3 +CO2 tal como vemos en la imagen, si se perturba agregándole más reactivo en este caso más agua, este buscara el equilibrio reaccionando el CO2 para producir más H2CO3 y así volver al equilibrio de la reacción.
Bueno ya explicado todo el principio de Le Chatelier, vallamos a la demostración visual. Aquí vamos!!
Demostracion del Equilibrio químico adaptada a las bebidas gaseosas.
CaCO3 + H2O + 2HCl = CaCl2 + 2H2O + CO2 si tomamos de la ecuación lo siguiente, nos queda:
2CO2 + H2O produce H2CO3 +CO2 (en equilibrio)
Una vez en equilibrio, vemos en la demostración como el CO2 está disuelto en el agua y el que está libre en la botella a una concentración, temperatura y presión constante una vez llega al equilibrio. Pero si perturbamos la reacción cambiando su presión al abrir la botella, se puede apreciar cómo se libera el CO2 disuelto en el agua, tratando de equilibrar la reacción generando más CO2 gaseoso.
Pero una vez se le agrega más CO2 a la botella vemos como las burbujas de CO2 desaparecen y deja de liberar el gas, lo que quiere decir que la reacción se inclinó hacia los productos disolviendo el CO2 en el agua creando mas H2CO3.
Bueno mis estimados colegas espero que el mundo molecular de la química de las reacciones les haya dado otra perspectiva de lo que ocurre cuando abrimos una gaseosa y no las tomamos, la curiosidad por lo que no vemos es lo que nos lleva apreciar más las cosas y entender al mundo que nos rodea.
Gracias y hasta la próxima.
Bibiografia
Quimica General – Raymond Chang, 7 editions.
https://veroaguilazenteno.files.wordpress.com/2011/08/quimica-general-raymond-chang.pdf
Buenas explicación del principio de Le Chatelier amigo @eleonardo. Muy didacto. Si me permites sugerirte, dale formato a las formulas químicas para mejorar la presentación. Saludos!
gracias amigo! dame un ejemplo xfa xq no conozco comando para colocar los sub-indices a las formulas. y por imágenes es imposible xq no puedo intercalar imágenes en el párrafo, y colocarlo como su nombre original era hacer el texto mucho mas largo y no quería eso. gracias por la sugerencia y xfa si conoces el comando facilitamelo para mejorar.
Descuida, no hay problema. Prueba con < sub > antes del número que vas a colocar como subindice y </ sub > despues (sin los espacios), así CO2 sería CO< sub>2</ sub>
fino hermano no sabia esa ya lo voy acomodar gracias por la ayuda. y no te disculpes que las sugerencias siempre son bienvenidas. saludos
De nada amigo, para esto estamos. Saludos!
Me gusta mucho la creatividad que implementas en tus artículos, esto hace que sea mucho más fácil de digerir para todos los lectores
gracias amiga! si la ciencia debe ser siempre divertida y que se entienda. no es tan fea y difícil como todos creemos! jaja gracias
Leonardo el tag es #steemstem
gracias carlos no me había fijado que la puse al revés! saludos
Mejor explicado imposible hermano gracias por compartir tu conocimiento, estaré atento a tus publicaciones.
gracias de verdad estoy muy contento por la receptividad de ustedes mis lectores.
Gracias por explicar El Principio del químico Le Chatelier aplicado en bebidas gaseosas. Saludos!
gracias a ti por leerme! siempre a la orden y pendiente de ustedes también!
Siendo un SteemStem Estados
Excelente explicación del equilibrio químico, lo mejor de todo el ejemplo que utilizas, muy buen aporte colega!
gracias compañero! es importante ser muy concreto y utilizar los mejores ejemplos para que todos entiendan no solo es llegar a los que conocen de la materia sino al que no tiene idea, ese es el objetivo principal.
Congratulations @eleonardo! You have completed some achievement on Steemit and have been rewarded with new badge(s) :
Click on any badge to view your own Board of Honor on SteemitBoard.
For more information about SteemitBoard, click here
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last announcement from @steemitboard!
Que bueno amigo, me gusto mucho como lo explicaste, excelente aporte como siempre. un saludo
saludos mi hermosa amiga! gracias por leerme! siempre contento porque estés en mis comentarios!
Que buen post hermano, de verdad que me gusta la forma tan sencilla y didactica como lo explicas para que este al alcance de muchos lectores que quizas no conozcan mucho del tema, me hiciste recordar mis primeros semestres de la carrera. Exitos.
esa era la idea colega! en hora buena porque recordaste esos momento y apuesto que esos conocimientos se activaron y refrescaron.