La ley de Dalton // Análisis

John Dalton(1766-1844), fuente imagen de dominio de wikimedia commons
Ley de Dalton
Esta ley, enunciada por el químico John Dalton, nos dice que las cantidades de unos mismos elementos, que reaccionan con una cantidad fija de otros elementos, para formar compuestos distintos se hallan en la relación de números enteros sencillos. En este efecto, se puede considerar los dos compuestos, que forman el carbono y el oxígeno, en el monóxido de carbono, CO, se combina 1.33 gr de oxigeno con 1 gr de carbono, mientras que en el dióxido de carbono CO2, se combina 2.66gr de oxigeno con 1 gr de carbono, para comparar las masas de oxígeno, que combinan con una masa fija de carbono 1 gr, se obtiene una relación de números enteros sencillos 1.33/2.66= ½;" La suma de las presiones parciales de cada gas, es igual a la presión total de la mezcla de gases".
Cuando cualquier cuerpo existe en el estado elástico (gaseoso), sus partículas fundamentales están a una distancia mayor que en cualquier otro estado; cada partícula ocupa el centro de una esfera relativamente grande y mantiene su posición sosteniendo a las demás a una distancia adecuada, que tendería a disminuir por la fuerza de gravedad u otra razón.
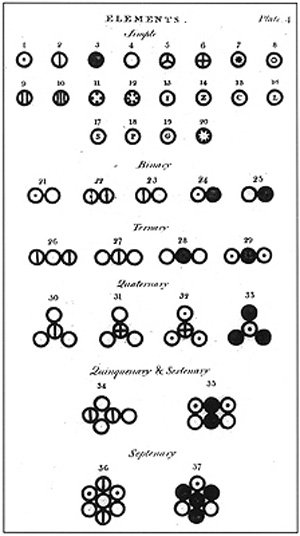
Varios átomos y moléculas representadas en el libro de Dalton titulado A New System of Chemical Philosophy (1808)., fuente de imagen de dominio de wikimedia commons,Author haade
Dalton, fue el primero en publicar una tabla de pesos atómicos relativos. Seis elementos aparecen en esta tabla: hidrógeno, oxígeno, nitrógeno, carbono, azufre y fósforo, atribuyendo convencionalmente al átomo de hidrógeno el peso de una unidad.
Hipótesis atómico-molecular de Dalton.
En 1803, expuso su teoría atómica – molecular, que explicaba y de base a su filosofía, en donde las leyes ponderales con tres hipótesis.
1-. Los elementos están formados por átomos, todos los átomos de unos mismos elementos son iguales, entre si y distintos de los átomos de los demás elementos, de tal manera que Dalton no conocía la existencia de los isótopos, es decir, que los átomos de un mismo elemento pueden ser algo distintos.
2-. Los compuesto están formados por moléculas de un mismo compuesto, son iguales entre si y distintos de las moléculas demás compuestos; las moléculas contiene los átomos, que forman el compuesto.
3-. Las combinaciones químicas constituyen una reordenación de los átomos, que formaban las moléculas de las sustancias iniciales, que se agrupan formando los productos de la reacción.
Gracias a Dalton, se tomó una nueva base filosófica bajo el esquema de la química, de tal manera, que el análisis y la síntesis se limitan a la separación o combinación de las partículas, respectivamente, ninguna nueva creación o destrucción de la materia está al alcance de la química.
También tenemos otros aportes, que dieron la compresión a fenómeno de temperatura, como lo fue de describir gracias a sus experimentos, para determinar la presión de vapor de agua, en varios puntos entre 0 y 100 °C (32 y 212 °F), Dalton llegó a la conclusión a partir de las observaciones de la presión de vapor de seis líquidos diferentes, que la variación de la presión de vapor, para todos los líquidos es equivalente, para la misma variación de la temperatura, determinados a partir de vapor a cualquier presión.
Este científico padecía un tipo menos común de ceguera al color, la deuteranopia, en la que faltan los conos sensibles a longitudes de onda medianas, en lugar de funcionar con una forma mutada de su pigmento, como en el tipo más común de ceguera al color, lo que hoy para estudio de la medicina es el Daltonismo, tanto es el caso, que dono su ojo después de su muerte, para que sirviera de estudio sobre lo que él padecía, y avanzaran más el estudio de esta patología.
Bibliografía.
Fundamentos de química - Página 90 por Ralph A. Burns - 2003.
Química 2: Cálculos en las reacciones y química del carbono por Víctor Manuel Ramírez Regalado - 2015.
Introducción a la historia de la química por Soledad ESTEBAN SANTOS - 2010.
