5. 系统的体积特性
若真如 (4.1)-(4.5) 所示,在稳态条件下,反应 (4.1) 使体积减半,而其余反应不改变系统的体积。
正常情况下,除了硅,气体由硅烷,氢气组成。即,被转换的醇,其体积一定会减少一半,变成了硅烷和氢气。
假如 M 摩尔醇都被转化为硅烷,则流通的体积减少一半。如果流动体积不变,反应没有发生。
如果尾气含氢,则标志着(4.2)-(4.4)发生了。氢气很少,转换方向不利。氢愈多,反应愈强烈。
系统堵塞故障由反应 (4.5) 所致。
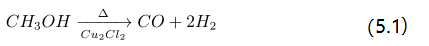
一个体积甲醇分解得到三体积的气体。在稳态条件下,气体流速增加两倍,检测尾气成分可以做出判断。
6.三相反应模式
在甲醇与硅合成烷氧基硅烷的直接合成技术中,大多数专利采用三相反应模式。在反应器中加入高沸点溶剂,
同时存在气-液-固三种形态。有关专利请在幸松名专著中查找,本文不重引。
在这个过程中,溶剂到底起什么作用,是个值得探讨的问题。有人称之为悬浮剂,因为溶剂的存在,
固体物借溶剂得到浮力,因而有利于搅拌,有利于固体物料的分散和传质传热。
全混反应实验模型借助机械作用使固体物运动,在运动中与气相反应物充分接触。实现气固反应。
溶剂的存在,减轻固体物料对搅拌器的磨损。如果是这样,溶剂选择的目标参数是比重,比重越大越好。
反应 (5.1) 表明,在甲醇与硅合成烷氧基硅烷的直接合成过程中,若以氯化亚铜作催化剂,必须有极性溶剂存在,起着极性解离作用。否则反应不会倾向烷氧基硅烷方向,而是分解,(4.1)-(4.5) 不会发生。
因此,溶剂的最重要的作用是所谓溶剂化效应,使醇解离而不是分解。
由此,使醇按指定模式解离是提高选择性的关键,解离的速度制约反应速度。溶剂的设计和选择很重要。按这一实验模型,溶剂的选择目标参数是极性,极性越强越好。
三相反应技术有一些致命的弱点。溶剂占据了一定的反应器空间。
高纯度高沸点溶剂十分昂贵,带来了新的杂质源和新的成本要素。
如果溶剂不起解离作用,其存在必起隔离作用,使气相反应物和固体颗粒隔离开来。
固体颗粒周围增加了新物质,氛围更加复杂,增加了气体扩散的阻力。
原料气在溶剂中形成气泡,必须有高速搅拌来使系统均相化。
搅拌速度的提高又加大了固体颗粒与搅拌器之间的摩擦力,也使液相乳化,甚至需要加入抗乳化剂,系统越来越复杂。
溶剂的应用也必定制约生产规模。这些问题促使人们寻找摆脱溶剂的方法。
是否存在某个条件,不用溶剂,产出三甲氧基硅烷,有待研究。
摆脱溶剂的关键是保证醇的解离模式为 RO-H 键断裂,没有了溶剂的极性,就必须寻求特殊的催化剂或某种其他技术。
7. 化学吸附
在反应进行条件下,甲醇及 B
i(i=2,3,4,5) 是气相物,而 Si 是固体粉末。
因此,反应(4.2)-(4.5})可以看作是气-液或气-气反应,反应(4.1)则是气固非均相的。
每个硅原子地位不可能平等,只有与甲醇发生接触的被激活硅的原子有机会参与反应。上述第四节的均相反应模型需要修正。
根据物理化学和化学反应工程的一般原理,当只考虑反应(4.1)时,过程包括以下 4 个步骤:
- 原料气向固体表面扩散;
- 原料气被固相物料吸附;
- 在活性中心处进行化学反应;
- 产物气从固相物料表面解吸进入气体物流中。
这个过程叫做化学吸附。它一定会经历扩散、吸附、化学反应和产物解吸四个过程,对应耗去四个在宏观尺度上很小的时间片段,
t
扩散, t
吸附, t
反应, t
解吸 四段时间,称为一个吸附周期。
这些量是些统计量。硅与醇的化学吸附可以想象为解离化学吸附。醇按需要解离,否则难以离解得到所需的产物。
但是,甲醇究竟是由于硅的表面吸附作用解离,还是溶剂的极化作用而解离或者二者兼有?不同的解离机理其扩散方式不一样。
吸附解离的扩散是甲醇的扩散,解离发生在硅粉表面和空隙中。溶剂极性化作用的解离发生在溶剂中,扩散是未解离的醇与解离出的离子的扩散。
这二者对反应的控制方式不同,加速反应的措施不同,实验模型不同。