21-04-2025 - Exercise - Stoichiometric Coefficient [EN]-[IT]

Cover background image generated with AI, software used: copilot microsoft
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
[ENGLISH]
21-04-2025 - Exercise - Stoichiometric Coefficient [EN]-[IT]

Image generated with AI, Microsoft Copilot
With this post I would like to provide some brief notions regarding the topic mentioned in the subject.
The context in which we operate is that of Chemistry
(code notes: MOD-xx)
Stoichiometric Coefficient
When we talk about chemistry and molecules we cannot fail to talk about the Stoichiometric Coefficient.
Chemical formulas are fundamental for understanding chemistry itself.
Let's look at one as an example.
Let's take for example the combustion reaction of methane.

This is a balanced chemical formula for the combustion of methane.
This formula shows that when methane burns in the presence of oxygen, a complete reaction occurs that produces carbon dioxide (CO2) and water (H2O)
In this formula the stoichiometric coefficients are as follows:
1 for methane CH4 (hydrocarbon)
2 for oxygen O2 (molecular oxygen, the one we breathe)
1 for carbon dioxide CO2 (carbon dioxide produced by combustion)
2 for water H2O
In the image below the stoichiometric coefficients are shown in red

As we wrote, the formula shows a balanced chemical reaction because, even if arranged differently, both on the left and on the right we have the same quantities of atoms.
If we try to analyze the hydrogen atoms we will see that in the left term there are 4 and in the right term there are always 4.
Here is an image for further clarification
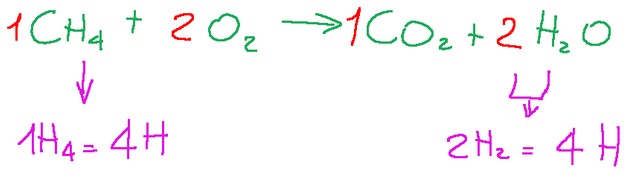
Exercise
Let's now try to balance the following chemical reaction by adding the stoichiometric coefficients.
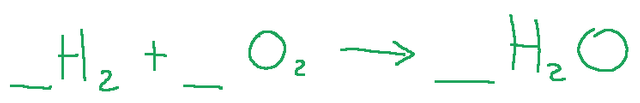
Let's now find the stoichiometric coefficients that balance the reaction. Our goal will be to have the same number of atoms on both the left and right sides of our formula.
The result will be as follows
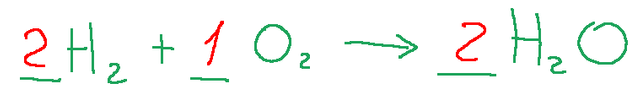
Verify
Let's try to verify the hydrogen atoms.
On the left there are 4, we have 2 H atoms multiplied by the stoichiometric coefficient of 2, that makes 4 H atoms. On the right we have exactly the same thing.
Let's try to verify the oxygen atoms.
On the left there are 2, we have 2 O atoms multiplied by the stoichiometric coefficient of 1, that makes 2 O atoms. On the right we have an oxygen atom multiplied by the stoichiometric coefficient of 2, so on the right we also have 2 oxygen atoms.
Usually the stoichiometric coefficient of 1 is omitted in balanced formulas, so our final result will be the following.
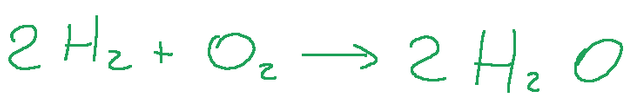
Conclusions
The stoichiometric coefficient is important because it balances chemical reactions, allows us to make accurate predictions, represents real quantities, and finally it also allows us to better understand how a reaction occurs.
Question
There is no direct inventor of the stoichiometric coefficient. Did you know that Antoine Lavoisier (French chemist, 1743-1794) is considered the father of modern chemistry and that his law is the conceptual basis of stoichiometric coefficients?

[ITALIAN]
21-04-2025 - Esercizio - Coefficiente stechiometrico [EN]-[IT]

Immagine generata con IA, Microsoft Copilot
Con questo post vorrei fornire alcune brevi nozioni a riguardo dell’argomento citato in oggetto.
Il contesto in cui operiamo è quello della Chimica
(code notes: MOD-xx)
Coefficiente stechiometrico
Quando parliamo di chimica e di molecole non possiamo non parlare del Coefficiente stechiometrico.
Le formule chimiche sono fondamentali per la comprensione stessa della chimica.
Vediamone una come esempio.
Prendiamo ad esempio la reazione di combustione del metano.

Questa è una formula chimica bilanciata che riguarda la combustione del metano.
Questa formula mostra che quando il metano brucia in presenza di ossigeno avviene una reazione completa che produce anidride carbonica (CO2) e acqua (H2O)
In questa formula i coefficienti stechiometrici sono i seguenti:
1 per il metano CH4 (idrocarburo )
2 per l'ossigeno O2 (ossigeno molecolare, quello che respiriamo)
1 per il diossido di carbonio CO2 (anidride carbonica prodotta dalla combustione)
2 per l'acqua H2O
Nell'immagine qui sotto riportata i coefficienti stechiometrici sono riportati in rosso

Come abbiamo scritto la formula mostra una reazione chimica bilanciata perché, anche se disposti in maniera diversa, sia a sinistra che a destra abbiamo le stesse quantità di atomi.
Se proviamo ad analizzare gli atomi di idrogeno vedremo che nel termine sinistro sono 4 e nel termine destro sono sempre 4.
Qui di seguito un immagine per maggior chiarimento
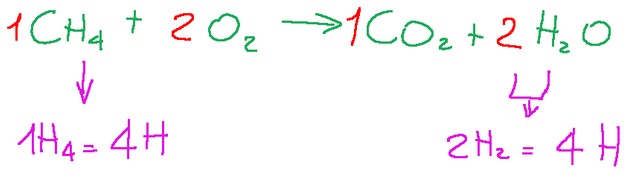
Esercizio
Proviamo ora a bilanciare la seguente reazione chimica aggiungendo i coefficienti stechiometrici.
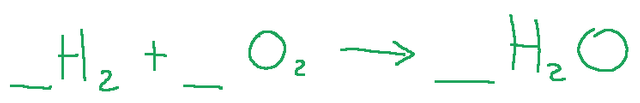
Troviamo ora i coefficienti stechiometrici che bilanciano la reazione. Il nostro obiettivo sarà avere gli stessi numeri di atomi sia nella parte sinistra che nella parte destra della nostra formula.
Il risultato sarà il seguente
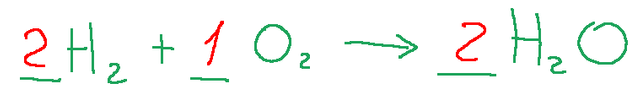
Verifica
Proviamo a verificare gli atomi di idrogeno.
A sinistra sono 4, abbiamo 2 atomi di H moltiplicati per il coefficiente stechiometrico di 2, fanno 4 atomi di H. A destra abbiamo esattamente la stessa cosa.
Proviamo a verificare gli atomi di ossigeno.
A sinistra sono 2, abbiamo 2 atomi di O moltiplicati per il coefficiente stechiometrico di 1, fanno 2 atomi di O. A destra abbiamo un atomo di ossigeno moltiplicato per il coefficiente stechiometrico 2, quindi anche a destra abbiamo 2 atomi di ossigeno.
Solitamente il coefficiente stechiometrico di 1 viene ommesso nelle formule bilanciate, quindi il nostro risultato finale sarà il seguente.
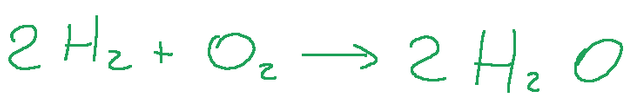
Conclusioni
Il coefficiente stechiometrico è importante perché bilancia le reazioni chimiche, permette di fare previsioni accurate, rappresenta quantità reali, infine esso ci permette anche di capire meglio come avviene una reazione.
Domanda
Non c'è un inventore diretto del coefficiente stechiometrico. Lo sapevate però che Antoine Lavoisier (chimico francese, 1743-1794) è considerato il padre della chimica moderna e che la sua legge è la base concettuale dei coefficienti stechiometrici?
THE END
Antoine Lavoisier was a great scientist . I think he was the first to write list of elements
0.00 SBD,
0.07 STEEM,
0.07 SP
You are right, I have informed myself and Antoine Lavoisier is considered the first scientist to have made a list of chemical elements. In his work called approximately “Elementary Treatise of Chemistry” released in 1789 he wrote a systematic list of chemical elements. He identified 33 of them. With this work Lavoisier laid the foundation for the modern definition of chemical element. Thanks for your valuable comment
0.00 SBD,
0.07 STEEM,
0.07 SP
This post has been upvoted by @italygame witness curation trail
If you like our work and want to support us, please consider to approve our witness
Come and visit Italy Community
0.00 SBD,
0.07 STEEM,
0.07 SP
Forse una donna avrebbe potuto inventarlo, lasciatemi spiegare: La moglie di Albert Einstein era una donna molto intelligente, si dice che sia stata la madre della teoria della relatività, anche la fisica e la matematica la rappresentano, molte donne nella nostra storia sono state eccezionali e come mogli di alcuni scienziati hanno aiutato i loro mariti nelle loro invenzioni, dobbiamo dare credito a queste donne di talento
0.00 SBD,
0.07 STEEM,
0.07 SP
Upvoted! Thank you for supporting witness @jswit.
0.00 SBD,
0.07 STEEM,
0.07 SP