均相复杂反应的实验模型
要点 采用简单反应的实验模型研究复杂反应,由单个全混釜作间歇操作,让反应任意地进行,原料的转换率可以很高,而目标产物浓度很低,甚至为零,装置效益很差。这一实验模型用于复杂反应不宜。
α Aa+ βBb4 → μAb+ νamBb4-m,(m=0,1,2,3,4) ------(1)
能同时产生 m=0,1,2,3,4 的 5 种产物。目标产物通常为m=1 或 2。
反应的机理不明确。根据实验现象,可以假定以下几个反应存在并会相继发生
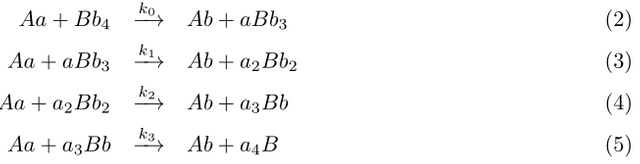
∑4i=0Bi=M=常数 ------(6)
∑4i=0dBi(t)/dt=0 ------(7)
随着 A 的增加,置换掉等量的 b,活性 b 数目以同样的速率减少。当 t=0 时,
B0(0)=M, Bi(0)=0, (i=1,2,3,4) ------(8)
B 的活性键总数为
H=4B0(0)N0 = 4MN0
式中 N0 为阿佛加德罗常数。任一时刻 t, A 加入的累积量为 vt,被置换掉的 b 总数为
∑4i=0iBi(t)=vtN0
剩余活性 b 总数为
∑4i=0(4-i)Bi(t)=H-vtN0。
可以得到微分方程组,求解得到宏观动力学方程组(见最后一节附录)。
我们强调这些方程是宏观的,因为我们是在工业环境下,没有条件讨论过程机理。
但不妨碍我们宏观地研究动力学过程。
ki(i=0,1,2,3) 等 4 个参数需要测定。
可以不直接测量反应速率,测量某一时刻 t 的浓度 Bi(i=0,1,2,3,4),近似估算出反应速率。
作为宏观分析,现在暂时假定一组基本参数,进行模拟计算。
得到浓度-时间变化曲线如图 1 所示。图中的矩形 EFGH,EF 边长为 M;FG 边为时间轴;F 为 t=0;
G 为使全部B变为 a4B 的反应终点 tend。
Bi(t)(i=0,1,2,3,4) 分别为 5 种产物浓度随时间的变化曲线。
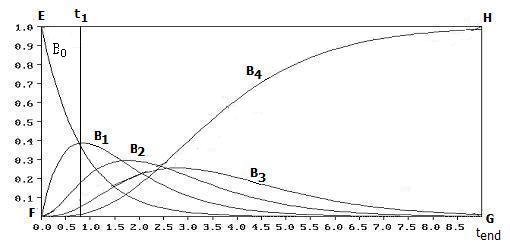 图 1. 一个复杂反应过程的模拟
从 t=0 到 t=tend 的整个过程,宏观上可以分为三个阶段:
第一阶段,以(2)式的反应为主。 B2,B3,B4 相继出现,其浓度不大。在这一阶段内,B的浓度远远大于A 的浓度,产生 a2Bb2 的概率很小,多于2个 b 被取代的可能性更小。
第二阶段,除反应(2)外,向 B2,B3,B4 的转换加强。
反应具有竞争性,三种物质竞争消耗 Aa,因此,实际上,Aa 的消耗不是线性的。
第三阶段,竞争减弱,以向 Bb4的转换为主。
无论怎样设定这些参数,结果大同小异。不管后面几个反应速率设定得多么低,以上的几个特征不会改变。
B1,B2,B3 相继出现,并逐渐达到峰值,随后浓度逐渐降低,只有 B4只增不减。该模拟反映了过程的现实特征。
只要有 A 和不饱和的 B 存在,
即使没有 B0,反应照样继续进行。一旦没有 A 存在,则所有反应停止。因此,技术的关键是在一个恰当的时刻停止加入A。
在这样的过程中,采用简单反应的实验模型,用单个全混釜作间歇操作,让反应任意地进行,
原料的转换率可以很高,但目的产物浓度很低,乃至为零。单个全混釜作间歇操作不是复杂反应的合适选择。
按照复杂反应的观点,反应存在阶段性,产物存在选择性。实验的目的,是选择反应条件使有利于目标产物的提高,而不利用副产物的生成。为了提高选择性,需要选择终止反应的时间。在副产物还没有生成或浓度很低的时候,将目标产物提取出来,不让它们转化成副产物。然后进入下一个反应周期。逻辑上,这个时刻应该在目标产物峰出现的时刻。实际上应该在此之前。假定所需要的产物是B1。在某一时刻 t1,B1 的浓度达到最大,此时,B2, B3, B4 相继出现。此后,B1 浓度逐渐下降,向 B2, B3, B4转换。
图 1 中,在时刻 t1,B0 已经消耗63%,b 则被取代约 8%,B1 占约 38%,副产物占25%。如果在此时停加 A,则向 Bi 的转化停止。因此,选定控制方案为:选取流速 v,使 A 加入 8% 后反应停止,出料,回收B0。B1 产率 38%,原料利用率 75%。
t1 前后有一个稳健操作期,在这个时期内,B1 浓度变化不大。如果修改控制方案为不等到时刻 t1,例如 0.5 分处,B4几乎还没出现,B2, B3 合计只占 11 %,B1浓度32 %,B0 转换率约 43 %(余约57 %) 原料总利用率可达89 %。
可操作性取决于物料的形态与性质。假如组分 A 与 B 都是液态物质,如果目的产物是气态的,其可操作性很好。假如目的产物也是液态的,沸点高于介质。则产物越在前,要从反应液中蒸馏出百分之几的产物,回收原料,能耗与成本很高,效率很低,很不合算。如果 B1 的沸点低于 A 或 B,应该把操作温度调整到相应的沸点以上。如果 B1 的沸点高于 A 或 B 及介质(假如反应在介质中进行),则该系统不可行。
图 1. 一个复杂反应过程的模拟
从 t=0 到 t=tend 的整个过程,宏观上可以分为三个阶段:
第一阶段,以(2)式的反应为主。 B2,B3,B4 相继出现,其浓度不大。在这一阶段内,B的浓度远远大于A 的浓度,产生 a2Bb2 的概率很小,多于2个 b 被取代的可能性更小。
第二阶段,除反应(2)外,向 B2,B3,B4 的转换加强。
反应具有竞争性,三种物质竞争消耗 Aa,因此,实际上,Aa 的消耗不是线性的。
第三阶段,竞争减弱,以向 Bb4的转换为主。
无论怎样设定这些参数,结果大同小异。不管后面几个反应速率设定得多么低,以上的几个特征不会改变。
B1,B2,B3 相继出现,并逐渐达到峰值,随后浓度逐渐降低,只有 B4只增不减。该模拟反映了过程的现实特征。
只要有 A 和不饱和的 B 存在,
即使没有 B0,反应照样继续进行。一旦没有 A 存在,则所有反应停止。因此,技术的关键是在一个恰当的时刻停止加入A。
在这样的过程中,采用简单反应的实验模型,用单个全混釜作间歇操作,让反应任意地进行,
原料的转换率可以很高,但目的产物浓度很低,乃至为零。单个全混釜作间歇操作不是复杂反应的合适选择。
按照复杂反应的观点,反应存在阶段性,产物存在选择性。实验的目的,是选择反应条件使有利于目标产物的提高,而不利用副产物的生成。为了提高选择性,需要选择终止反应的时间。在副产物还没有生成或浓度很低的时候,将目标产物提取出来,不让它们转化成副产物。然后进入下一个反应周期。逻辑上,这个时刻应该在目标产物峰出现的时刻。实际上应该在此之前。假定所需要的产物是B1。在某一时刻 t1,B1 的浓度达到最大,此时,B2, B3, B4 相继出现。此后,B1 浓度逐渐下降,向 B2, B3, B4转换。
图 1 中,在时刻 t1,B0 已经消耗63%,b 则被取代约 8%,B1 占约 38%,副产物占25%。如果在此时停加 A,则向 Bi 的转化停止。因此,选定控制方案为:选取流速 v,使 A 加入 8% 后反应停止,出料,回收B0。B1 产率 38%,原料利用率 75%。
t1 前后有一个稳健操作期,在这个时期内,B1 浓度变化不大。如果修改控制方案为不等到时刻 t1,例如 0.5 分处,B4几乎还没出现,B2, B3 合计只占 11 %,B1浓度32 %,B0 转换率约 43 %(余约57 %) 原料总利用率可达89 %。
可操作性取决于物料的形态与性质。假如组分 A 与 B 都是液态物质,如果目的产物是气态的,其可操作性很好。假如目的产物也是液态的,沸点高于介质。则产物越在前,要从反应液中蒸馏出百分之几的产物,回收原料,能耗与成本很高,效率很低,很不合算。如果 B1 的沸点低于 A 或 B,应该把操作温度调整到相应的沸点以上。如果 B1 的沸点高于 A 或 B 及介质(假如反应在介质中进行),则该系统不可行。
1. 反应的宏观分析
复杂反应是一个很宽的概念,为确定起见,我们现在研究其中一类反应---两种物质A 和 B 的反应的实验模型 。 用 A 表示分子A 的核,B 表示分子B 的核,用对应的小写字母表示分子内部的取代或可取代基团。 设分子A 是一价的,有一个基团 a,分子B 是四价的,有 4 个基团 b。 假设 A 与 B 反应 可以生成多种产物且反应不可逆。即, A 的基团 a 可以取代 B 的一个基团 b。 宏观上有反应式 图 1. 一个复杂反应过程的模拟
从 t=0 到 t=tend 的整个过程,宏观上可以分为三个阶段:
第一阶段,以(2)式的反应为主。 B2,B3,B4 相继出现,其浓度不大。在这一阶段内,B的浓度远远大于A 的浓度,产生 a2Bb2 的概率很小,多于2个 b 被取代的可能性更小。
第二阶段,除反应(2)外,向 B2,B3,B4 的转换加强。
反应具有竞争性,三种物质竞争消耗 Aa,因此,实际上,Aa 的消耗不是线性的。
第三阶段,竞争减弱,以向 Bb4的转换为主。
无论怎样设定这些参数,结果大同小异。不管后面几个反应速率设定得多么低,以上的几个特征不会改变。
B1,B2,B3 相继出现,并逐渐达到峰值,随后浓度逐渐降低,只有 B4只增不减。该模拟反映了过程的现实特征。
只要有 A 和不饱和的 B 存在,
即使没有 B0,反应照样继续进行。一旦没有 A 存在,则所有反应停止。因此,技术的关键是在一个恰当的时刻停止加入A。
在这样的过程中,采用简单反应的实验模型,用单个全混釜作间歇操作,让反应任意地进行,
原料的转换率可以很高,但目的产物浓度很低,乃至为零。单个全混釜作间歇操作不是复杂反应的合适选择。
按照复杂反应的观点,反应存在阶段性,产物存在选择性。实验的目的,是选择反应条件使有利于目标产物的提高,而不利用副产物的生成。为了提高选择性,需要选择终止反应的时间。在副产物还没有生成或浓度很低的时候,将目标产物提取出来,不让它们转化成副产物。然后进入下一个反应周期。逻辑上,这个时刻应该在目标产物峰出现的时刻。实际上应该在此之前。假定所需要的产物是B1。在某一时刻 t1,B1 的浓度达到最大,此时,B2, B3, B4 相继出现。此后,B1 浓度逐渐下降,向 B2, B3, B4转换。
图 1 中,在时刻 t1,B0 已经消耗63%,b 则被取代约 8%,B1 占约 38%,副产物占25%。如果在此时停加 A,则向 Bi 的转化停止。因此,选定控制方案为:选取流速 v,使 A 加入 8% 后反应停止,出料,回收B0。B1 产率 38%,原料利用率 75%。
t1 前后有一个稳健操作期,在这个时期内,B1 浓度变化不大。如果修改控制方案为不等到时刻 t1,例如 0.5 分处,B4几乎还没出现,B2, B3 合计只占 11 %,B1浓度32 %,B0 转换率约 43 %(余约57 %) 原料总利用率可达89 %。
可操作性取决于物料的形态与性质。假如组分 A 与 B 都是液态物质,如果目的产物是气态的,其可操作性很好。假如目的产物也是液态的,沸点高于介质。则产物越在前,要从反应液中蒸馏出百分之几的产物,回收原料,能耗与成本很高,效率很低,很不合算。如果 B1 的沸点低于 A 或 B,应该把操作温度调整到相应的沸点以上。如果 B1 的沸点高于 A 或 B 及介质(假如反应在介质中进行),则该系统不可行。
图 1. 一个复杂反应过程的模拟
从 t=0 到 t=tend 的整个过程,宏观上可以分为三个阶段:
第一阶段,以(2)式的反应为主。 B2,B3,B4 相继出现,其浓度不大。在这一阶段内,B的浓度远远大于A 的浓度,产生 a2Bb2 的概率很小,多于2个 b 被取代的可能性更小。
第二阶段,除反应(2)外,向 B2,B3,B4 的转换加强。
反应具有竞争性,三种物质竞争消耗 Aa,因此,实际上,Aa 的消耗不是线性的。
第三阶段,竞争减弱,以向 Bb4的转换为主。
无论怎样设定这些参数,结果大同小异。不管后面几个反应速率设定得多么低,以上的几个特征不会改变。
B1,B2,B3 相继出现,并逐渐达到峰值,随后浓度逐渐降低,只有 B4只增不减。该模拟反映了过程的现实特征。
只要有 A 和不饱和的 B 存在,
即使没有 B0,反应照样继续进行。一旦没有 A 存在,则所有反应停止。因此,技术的关键是在一个恰当的时刻停止加入A。
在这样的过程中,采用简单反应的实验模型,用单个全混釜作间歇操作,让反应任意地进行,
原料的转换率可以很高,但目的产物浓度很低,乃至为零。单个全混釜作间歇操作不是复杂反应的合适选择。
按照复杂反应的观点,反应存在阶段性,产物存在选择性。实验的目的,是选择反应条件使有利于目标产物的提高,而不利用副产物的生成。为了提高选择性,需要选择终止反应的时间。在副产物还没有生成或浓度很低的时候,将目标产物提取出来,不让它们转化成副产物。然后进入下一个反应周期。逻辑上,这个时刻应该在目标产物峰出现的时刻。实际上应该在此之前。假定所需要的产物是B1。在某一时刻 t1,B1 的浓度达到最大,此时,B2, B3, B4 相继出现。此后,B1 浓度逐渐下降,向 B2, B3, B4转换。
图 1 中,在时刻 t1,B0 已经消耗63%,b 则被取代约 8%,B1 占约 38%,副产物占25%。如果在此时停加 A,则向 Bi 的转化停止。因此,选定控制方案为:选取流速 v,使 A 加入 8% 后反应停止,出料,回收B0。B1 产率 38%,原料利用率 75%。
t1 前后有一个稳健操作期,在这个时期内,B1 浓度变化不大。如果修改控制方案为不等到时刻 t1,例如 0.5 分处,B4几乎还没出现,B2, B3 合计只占 11 %,B1浓度32 %,B0 转换率约 43 %(余约57 %) 原料总利用率可达89 %。
可操作性取决于物料的形态与性质。假如组分 A 与 B 都是液态物质,如果目的产物是气态的,其可操作性很好。假如目的产物也是液态的,沸点高于介质。则产物越在前,要从反应液中蒸馏出百分之几的产物,回收原料,能耗与成本很高,效率很低,很不合算。如果 B1 的沸点低于 A 或 B,应该把操作温度调整到相应的沸点以上。如果 B1 的沸点高于 A 或 B 及介质(假如反应在介质中进行),则该系统不可行。
2. 用串联反应器实现
串联釜反应器是个奇妙的化学装置 ,若用 串联反应器 实现该反应,表面看实验有四个变量:串联级数 n, 单个釜有效容积 v,介质流速 vb,A 的流速 va。 由式(2) ---(5), 本实验没有体积效应,应该采用等容釜串联反应器,级数 n,则停留时间分布已经确定(查表, 不等容全混釜串联反应器的停留时间分布(续 1) )。 产物分布由停留时间分布确定。 单个釜有效容积 v, 介质流体(如果必须)与 B 定比混合备用,设计流速 vb为常数; A 的流速 va可变,反应时间 t 即停留时间,由总系统容积与总流速: va+vb 的体积流速之比确定。 这样,实验参数只有 n; va 两个。其中 n 只需很少的实验数目即可确定。整个实验的设计很简单。只需数个实验。3. 附:微分方程及其解
由式(2)---(5) 可以得到微分方程组 dB0(t)/dt=-k0B0Ca dB1(t)/dt=(k0B0-k1B1)Ca dB2(t)/dt=(k1B1-k2B2)Ca dB3(t)/dt=(k2B2-k3B3)Ca dB4(t)/dt=k3B3Ca 式中ki(i=0,1,2,3) 为反应速率。上述 5 个微分方程只有 4 个是独立的,满足关系(7)。 由于Ca 是一常数,可并入ki中。这些方程均可分别积分,但后一个方程依赖前一方程的积分结果。 可逐个积分,得到积分结果如下。其中 ci(i=0,1,2,3) 为积分常数。 B0(t)=c0exp(-k0t) c0=M B1(t)=c0k0[exp(-k0t) -c1 exp(-k1t)]/(k1-k0) c1=c0k0/(k1-k0) B2(t)=c0k0k1exp(-k0t)/[(k1-k0)(k2-k0)]+ c1k1exp(-k1t)/(k2-k1)+c2exp(-k2t) c2=c0k0k1/[(k2-k1)(k2-k0)] B3(t)=c0k0k1k2exp(-k0t)/[(k1-k0)(k2-k0)(k3-k0)]+ c1k1k2exp(-k1t)/[(k2-k1)(k3-k1)] +c2k2exp(-k2t)/(k2-k1)+c2exp(-k2t) c3=c0k0k1k2/[(k1-k0)(k2-k0)(k3-k0)]+c1k1k2/[(k2-k1)(k3-k1)]+c2k2/(k3-k2) B4(t) = M-(B0(t)+B1(t)+B2(t)+B3(t))参 考
- 幸松民,王一璐,《有机硅合成工艺及其应用》,化学工业出版社,北京,2002
- (苏)涅克拉索夫著,张青莲等译,《无机化学教程》,北京,高等教育出版社,1953
- 严宣申,王长富,《普通无机化学》,北京大学出版社,1987
- 陈甘棠 主编,《化学反应工程》,化学工业出版社,北京,1981
- 黄恩才 主编,《化学反应工程》,化学工业出版社,北京,1998
- 南京大学物理化学教研组等编 ,《物理化学》,人民教育出版社,北京,1961
- 傅献彩,沈文霞, 姚天扬, 《物理化学》,(第四版),人民教育出版社,北京,1990
- 周公度,《结构化学基础》,北京大学出版社,(1989)
- (美)Charles N.Satterfield 著, 庞礼译, 《实用多相催化》,北京大学出版社,1990
- HANDBOOK OF CHEMISTRY AND PHYSICS 82ND (2001-2002)
- 烷氧基硅烷的直接合成工艺, ZL 02113594.0 (2002)
- 胡华明,胡文斌,李凤仪 直接合成三烷氧基含氢硅烷反应器分析, 《化工中间体》,2006年5月号, (2006)
- 杨春晖,张 磊,李 季,杨 恺,葛士彬,胡成发,直接法合成三烷氧基硅烷的研究进展,《有机硅材料》Vol.24(1),(2010)